ความหมายและการเกิดพันธะเคมี
พันธะเคมีคือ แรงยึดเหนี่ยวที่อยู่ระหว่างอะตอมซึ่งทำให้อะตอมต่าง ๆ เข้ามาอยู่รวมกันเป็นโมเลกุลได้ การสร้างพันธะเคมีของอะตอมเกิดขึ้นได้ เนื่องจากอะตอมต้องการจะปรับตัวให้ตนเองมีเวเลนซ์อิเล็กตรอนครบ 8 หรือให้ใกล้เคียงกับการครบ 8 ให้มากที่สุด (ตามกฎออกเตต) ดังนั้นจึงต้องอาศัยอะตอมอื่น ๆ มาเป็นตัวช่วยให้อิเล็กตรอนเข้ามาเสริม หรือเป็นตัวรับเอาอิเล็กตรอนออกไป และจากความพยายามในการปรับตัวของอะตอมเช่นนี้เองที่ทำให้อะตอมมีการสร้างพันธะเคมีกับอะตอมอื่น ๆ
เรามาลองทำความเข้าใจในการเกิดพันธะเคมีของอะตอม จากตัวอย่างการเกิดพันธะเคมีในโมเลกุลแก๊สไฮโดรเจน (H2) ดังต่อไปนี้
2. เมื่ออะตอมของธาตุไฮโดรเจน 2 อะตอม เคลื่อนที่เข้ามาอยู่ใกล้กันในระยะพอเหมาะ อิเล็กตรอนของอะตอมไฮโดรเจนแต่ละอะตอมจะถูกนิวเคลียสของอะตอมอีกอะตอมหนึ่งพยายามดึงดูดเอาไว้ ทำให้อิเล็กตรอนเคลื่อนที่ได้ช้าลง และเมื่ออิเล็กตรอนเคลื่อนที่ได้ช้าลง จะทำให้ระดับพลังงานภายในโมเลกุลของอะตอมไฮโดรเจนลดต่ำลง อะตอมของไฮโดรเจนจึงมีความเสถียรมากขึ้น และแรงดึงดูดที่เกิดจากอะตอมของไฮโดรเจนดึงดูดอิเล็กตรอนนี้เอง ที่ทำให้อะตอของธาตุสามารถยึดเหนี่ยวกันได้
3. ระยะห่างระหว่างอะตอมไฮโดรเจนจะมีค่าคงที่ใกล้เคียงกันเสมอ เนื่องจากถ้าอะตอมของไฮโดรเจนทั้ง 2 เข้าใกล้กันมากเกินไป จะทำให้เกิดแรงผลักระหว่างนิวเคลียสของทั้งสองอะตอมมากเกินไป และถ้าหากอะตอมอยู่ห่างกันมากกว่านี้ แรงดึงดูดที่อะตอมมีต่อกันก็จะน้อยเกินไป จนไม่สามารถดึงดูดอิเล็กตรอนของอีกอะตอมได้
การสร้างพันธะเคมีของอะตอมสามารถเกิดขึ้นได้ในหลายลักษณะ โดยในแต่ละลักษณะจะมีสมบัติและความแข็งแรงของพันธะเคมีชนิดใดต่อกันนั้น จะขึ้นอยู่กับจำนวนเวเลนซ์อิเล็กตรอนและสมบัติของแต่ละอะตอมที่เข้ามาสร้างพันธะเคมีต่อกันเป็นสำคัญ โดยเราสามารถจำแนกพันธะเคมีได้เป็น 3 ชนิด คือ พันธะโคเวเลนต์ พันธะไอออนิกH และพันธะโลหะ
พันธะโลหะ
พันธะโลหะ (Metallic bond) หมายถึง แรงยึดเหนี่ยวที่ทำให้อะตอมของโลหะ อยู่ด้วยกันในก้อนของโลหะ โดยมีการใช้เวเลนต์อิเล็กตรอนร่วมกันของอะตอมของโลหะ โดยที่เวเลนต์อิเล็กตรอนนี้ไม่ได้เป็นของอะตอมหนึ่งอะตอมใดโดยเฉพาะ เนื่องจากมีการเคลื่อนที่ตลอดเวลา ทุกๆอะตอมของโลหะจะอยู่ติดกันกับอะตอมอื่นๆ ต่อเนื่องกันไม่มีที่สิ้นสุด จึงทำให้โลหะไม่มีสูตรโมเลกุล ที่เขียนกันเป็นสูตรอย่างง่าย หรือสัญลักษณ์ของธาตุนั้นเองสมบัติทั่วไปของโลหะ
- โลหะเป็นตัวนำไฟฟ้าที่ดี เพราะอิเล็กตรอนเคลื่อนที่ได้ง่าย
- โลหะมีจุดหลอมเหลวสูง เพราะเวเลนต์อิเล็กตรอนของอะตอมทั้งหมดในก้อนโลหะยึดอะตอมไว้อย่างเหนียวแน่น
- โลหะสามารถตีแผ่เป็นแผ่นบางๆได้ เพราะมีกลุ่มเวเลนต์อิเล็กตรอนทำหน้าที่ยึดอนุภาคให้เรียงกันไม่ขาดออกจากกัน
- โลหะมีผิวเป็นมันวาว เพราะกลุ่มอิเล็กตรอนที่เคลื่อนที่โดยอิสระมีปฏิกิริยาต่อแสง จึงสะท้อนแสงทำให้มองเห็นเป็นมันวาว
- สถานะปกติเป็นของแข็ง ยกเว้น Hg เป็นของเหลว
- โลหะนำความร้อนได้ดี เพราะอิเล็กตรอนอิสระเคลื่อนที่ได้ทุกทิศทาง
ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะคู่ เช่น ในโมเลกุลของออกซิเจนถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะสาม เช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนซ์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนซ์คือ BeCl2เป็นต้นชนิดของพันธะโคเวเลนต์
อะตอมที่เกิดพันธะ นักเคมีนิยมใช้การเขียนสัญลักษณ์แบบจุดของลิวอิส โดยประกอบด้วยสัญลักษณ์แทนนิวเคลียสกับอิเล็กตรอนในชั้นถัดจากเวเลนซ์อิเล็กตรอนเข้าไป และจุดรอบสัญลักษณ์แทนจำนวนเวเลนซ์อิเล็กตรอนของธาตุนั้น ๆ
ชนิดของพันธะโคเวเลนต์
พิจารณาจากจำนวนอิเล็กตรอนที่ใช้ร่วมกันของอะตอมคู่ร่วมพันธะ ดังนี้
ก. พันธะเดี่ยว เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน1 คู่ ใช้เส้น ( - ) แทนพันธะเดี่ยว
ข. พันธะคู่เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 2 คู่ ใช้เส้น 2 เส้น (= ) แทน 1 พันธะคู่ เช่น พันธะระหว่าง O ใน O2, O กับ C ใน CO2, C กับ H ใน C2H4
ค. พันธะสามเป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 3 คู่ ใช้เส้น 3 เส้น ( = ) แทน 1 พันธะสาม เช่น พันธะระหว่าง N กับ N ใน N2 , N กับ C ใน HCN
อะตอมที่เกิดพันธะ นักเคมีนิยมใช้การเขียนสัญลักษณ์แบบจุดของลิวอิส โดยประกอบด้วยสัญลักษณ์แทนนิวเคลียสกับอิเล็กตรอนในชั้นถัดจากเวเลนซ์อิเล็กตรอนเข้าไป และจุดรอบสัญลักษณ์แทนจำนวนเวเลนซ์อิเล็กตรอนของธาตุนั้น ๆ
ชนิดของพันธะโคเวเลนต์ พิจารณาจากจำนวนอิเล็กตรอนที่ใช้ร่วมกันของอะตอมคู่ร่วมพันธะ ดังนี้
ก. พันธะเดี่ยว เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน
1 คู่ ใช้เส้น ( - ) แทนพันธะเดี่ยว เช่น

ข. พันธะคู่เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 2 คู่ ใช้เส้น 2 เส้น (= ) แทน 1 พันธะคู่ เช่น พันธะระหว่าง O ใน O2, O กับ C ใน CO2, C กับ H ใน C2H4

ค. พันธะสามเป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 3 คู่ ใช้เส้น 3 เส้น ( = ) แทน 1 พันธะสาม เช่น พันธะระหว่าง N กับ N ใน N2, N กับ C ใน HCNตาราง โครงสร้างลิวอิสของโมเลกุลโคเวเลนต์บางชนิด

พันธะโคออร์ดิเนตโคเวเลนต์ คือ พันธะโคเวเลนต์ที่เกิดจากการใช้อิเล็กตรอนร่วมกันของอะตอมโดยอิเล็กตรอนคู่นี้มาจากอะตอมใดอะตอมหนึ่งไม่ได้มาจากทั้ง 2 อะตอม การเกิดพันธะจะเกิดเมื่อเกิดพันธะโคเวเลนต์ตามปกติ แล้วยังมีอะตอมใดอะตอมหนึ่งที่เวเลนซ์อิเล็กตรอนยังไม่ครบตามกฎออกเตต
โมเลกุลที่ไม่เป็นไปตามกฏออกเตด1. อิเล็กตรอนรอบอะตอมกลางน้อยกว่า 8 ในสารประกอบบางชนิด จำนวนอิเล็กตรอนที่ล้อมรอบอะตอมกลางมีจำนวนน้อยกว่าแปด เช่น เบอร์ริลเลียม ซึ่งเป็นธาตุหมู่ 2A ซึ่งมีการจัดเรียงอิเล็กตรอนเป็น 1s22s2 มีเวเลนซ์อิเล็กตรอน 2 ตัว อยู่ที่ออร์บิตัล 2s ในสภานะแก๊ส เบอร์ริลเลียมไฮไดรด์ (BeH2)เป็นโมเลกุลที่เสถียรโดยมีโครงสร้างลิวอิสดังรูป
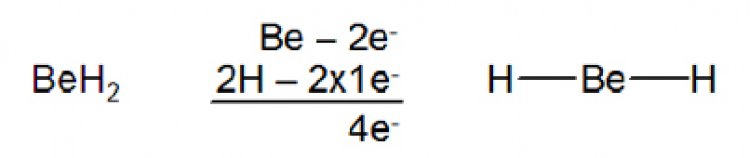
เห็นได้ว่า ที่อะตอมกลางมีเพียง 4 อิเล็กตรอนเท่านั้น ส่วนโบรอนซึ่งเป็นธาตุหมู่ 3A ที่อะตอมกลางของ BF3ก็มีเพียง 6อิเล็กตรอนเท่านั้น
2.โมเลกุล บางชนิดมีจำนวนอิเล็กตรอนเป็นเลขคี่ เช่น nitric oxide (NO) และ nitrogen dioxide (NO2)
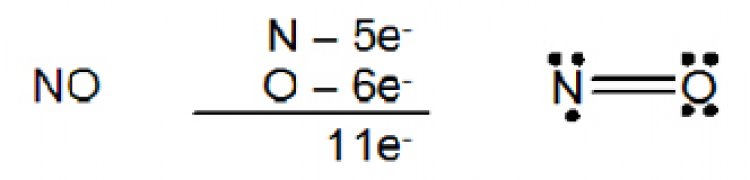
3. อิเล็กตรอนรอบอะตอมกลางมากกกว่า 8เกิดในกรณีที่อะตอมกลางเป็นธาตุในคาบที่สามเป็นต้นไป ซึ่งธาตุเหล่านี้มี 3d ออร์บิตัลที่ว่าง สามารถรับอิเล็กตรอนเพื่อสร้างพันธะได้ด้วย ตัวอย่างเช่น SF6 ซึ่งอะตอมกลางมีอิเล็กตรอน 12 ตัว ล้อมรอบ

การเขียนสูตรและเรียกชื่อสารโคเวเลนซ์
สูตรเคมี หมายถึง สัญลักษณ์ที่ใช้เพื่อแสดงว่าสารประกอบนั้นมีธาตุอะไรบ้างเป็นองค์ประกอบอย่างละกี่อะตอม สูตรเคมีแบ่งออกเป็น 3ประเภทคือ
1. สูตรโมเลกุล เป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้างอย่างละกี่อะตอม เช่น สูตรโมเลกุลของน้ำตาลกลูโคส คือ C6H12O6แสดงว่ากลูโคสประกอบด้วยธาตุ C , H และ O จำนวน 6 , 12 และ 6 อะตอมตามลำดับ
สำหรับสูตรโมเลกุล ของสารโคเวเลนต์โดยทั่วไป จะเขียนสัญลักษณ์ของธาตุในโมเลกุล เรียงลำดับคือ B , Si, C , P , H , S , I , Sr , Cl , O และ F เช่น ClF OF2, CO2เป็น ต้น2. สูตรอย่างง่าย เป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง มีอัตราส่วนของจำนวนอะตอมเป็นเท่าใด เช่น สูตรอย่างง่ายของกลูโคสคือ CH2O ซึ่งแสดงว่ากลูโคสประกอบด้วยธาตุ C, H และ O โดยมีอัตราส่วนอะตอมของ C : H : O = 1:
2 : 13. สูตรโครงสร้าง เป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง อย่างละกี่อะตอมและแต่ละอะตอมยึดเหนี่ยวกันด้วยพันธะเคมีอย่างไร จะเห็นได้ว่าสูตรโครงสร้างของสารให้ราบละเอียดเกี่ยวกับองค์ประกอบของธาตุต่าง ๆ ในโมเลกุลมากกว่าสูตรอย่างง่ายและสูตรโมเลกุล
สูตรโครงสร้างสามารถเขียนได้ 2 แบบคือ สูตรโครงสร้างแบบจุด (electron dot formula) หรือสูตรโครงสร้างแบบลิวอิส (Lwwis formula) และสูตรโครงสร้างแบบเส้น (graphic formula) สูตรโครงสร้างทั้ง 2 แบบจะแสดงเฉพาะเวเลนต์อิเล็กตรอนของอะตอมคู่ร่วมพันธะ
สูตรโครงสร้างแบบจุด
ใช้สัญลักษณ์เป็นจุด ( . ) แทนเวเลนต์อิเล็กตรอนโดยเขียนไว้รอบ ๆ สัญลักษณ์ของธาตุ หรืออาจจะใช้สัญลักษณ์เป็น x แทนเวเลนต์อิเล็กตรอนก็ได้เพื่อให้เห็นความแตกต่างระหว่างอิเล็กตรอนของธาตุคู่ร่วมพันธะต่างชนิดกันโดยทั่ว ๆ ไปการเขียนสูตรแบบจุดจะมีข้อกำหนดดังนี้
1. อะตอมของธาตุก่อนเขียน ให้เขียนแยกกัน และเขียนจุด ( . ) แสดงเวเลนต์อิเล็กตรอนล้อมรอบสัญลักษณ์ของธาตุ โดยมีจำนวนจุดเท่ากับจำนวนเวเลนต์อิเล็กตรอน เช่น
2. เมื่ออะตอม 2 อะตอมสร้างพันธะโคเวเลนต์ ให้เขียนสูตรแบบจุดของอะตอมทั้งสองไว้ด้วยกัน สำหรับอิเล็กตรอนที่ใช้ร่วมกัน ให้เขียนจุด ( . ) ไว้ในระหว่างสัญลักษณ์ของอะตอมคู่ร่วมพันธะ ส่วนอิเล็กตรอนที่ไม่ได้ร่วมกัน หรืออิเล็กตรอนที่ไม่ได้ใช้ในการสร้างพันธะ ให้เขียนด้วยจุดไว้บนอะตอมเดิม
จะเห็นได้ว่าการเขียนสูตรแบบจุดจำเป็นที่จะต้องทราบจำนวนเวเลนต์อิเล็กตรอนของธาตุคู่ร่วมพันธะก่อนซึ่งอาจจะทราบจากเลขอะตอมของธาตุ หลังจากนั้นจึงจะนำมาเขียนเป็นสูตรแบบจุดสูตรโครงสร้างแบบเส้นเป็นการเขียนสูตรโครงสร้างของโมเลกุลโคเวเลนต์อีกแบบหนึ่งซึ่งแตกต่างจากสูตรแบบจุดเล็กน้อย โดยกำหนดให้ใช้เส้นตรง ( - ) แทนอิเล็กตรอนคู่ร่วมพันธะ 1
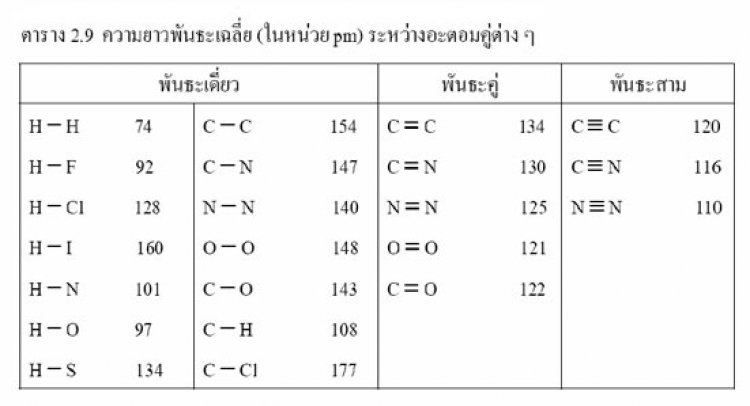
อะตอมบางคู่ เช่น C กับ C O กับ O และ N กับ N เป็นต้น สามารถเกิดพันธะได้มากกว่า 1 ชนิด และพันธะแต่ละชนิดที่เกิดขึ้น จะมีพลังงานพันธะและความยาวพันธะต่างกันคือ พันธะสามจะมีพลังงานพันธะมากว่าพันธะคู่ พันธะคู่จะมีพลังงานพันธะมากกว่าพันธะเดี่ยวตามลำดับ (พันธะสาม พันธะคู่ พันธะเดี่ยว) ส่วนความยาวพันธะ พันธะเดี่ยวจะมีความยาวพันธะมากกว่าพันธะคู่ พันธะคู่มีความยาวพันธะมากกว่าพันธะสาม ในการเกิดพันธะเคมีอะตอมจะต้องเข้าใกล้กันด้วยระยะเฉพาะระยะใดระยะหนึ่งเกินกว่าระยะนี้ไม่ได้จะเกิดการผลักกันหรือดึงดูดกันน้อยที่สุด และระยะนี้จะทำให้โมเลกุลมีพลังงานต่ำสุดและเสถียรที่สุด ระยะนี้เรียกว่าความยาวพันธะ
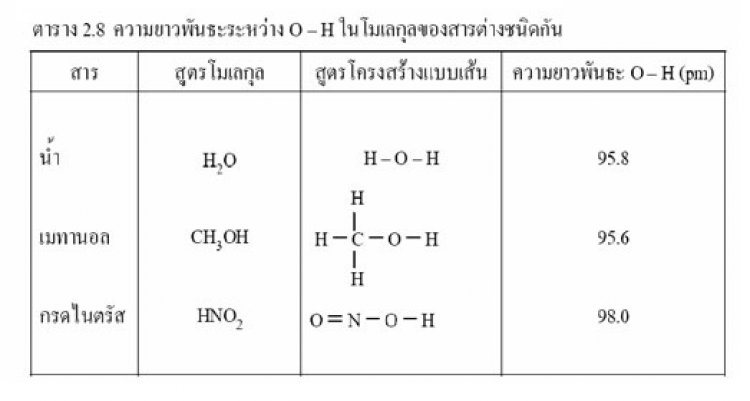
ความยาวพันธะหมายถึงระยะทางระหว่างนิวเคลียสของะตอมสองอะตอมที่สร้างพันธะกันในโมเลกุลแต่เนื่องจากระยะทางระหว่างนิวเคลียสของอะตอมที่เกิดพันธะกันไม่แน่นอนเนื่องจากอะตอมมีการสั่นสะเทือนอยู่ตลอดเวลานอกจากนั้นความยาวพันธะระหว่างอะตอมคู่หนึ่งที่เกิดพันธะชนิดเดียวกันในโมเลกุลต่างชนิดกันอาจจะไม่เท่ากันแต่จะมีค่าใกล้เคียงกันดังนั้นเมื่อกล่าวถึงความยาวพันธะจะหมายถึงความยาวพันธะเฉลี่ย
ความยาวพันธะของอะตอมชนิดเดียวกัน พันธะเดี่ยว > พันธะคู่ > พันธะสาม เช่น ความยาวพันธะ C - C เท่ากับ 154 พิโกเมตร, C = C เท่ากับ 134 พิโกเมตร, C C เท่ากับ 120พิโกเมตร
พลังงานพันธะพลังงานพันธะคือ พลังงานที่ใช้ไปเพื่อสลายพันธะระหว่าง อะตอมภายในโมเลกุลซึ่งอยู่ในสถานะก๊าซให้แยกออกจากกันเป็นอะตอม ในสถานะก๊าซในการเกิดพันธะเคมี จะเกี่ยวข้องกับพลังงาน 2 ประเภท คือ
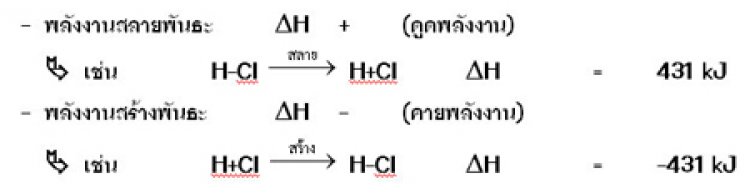
ในปฏิกิริยาเคมีที่เกิดขึ้นจากการให้สารทำปฏิกิริยากันแล้วได้สารใหม่เป็นโมเลกุลโควาเลนต์นั้น จะดูว่าเป็นปฏิกิริยาดูดหรือคายความร้อน ให้พิจารณาค่าของพลังงาน

พลังงานพันธะจะบอกความแข็งแรงของพันธะพันธะที่แข็งแรงมากจะมีพลังงานพันธะมากพันธะที่แข็งแรงน้อยจะมีพลังงานพันธะน้อย
พลังงานของปฏิกิริยาคำนวณได้จากพลังงานพันธะโดยอาศัยหลักการที่ว่าสารตั้งต้นทุกตัวต้องดูดพลังงานเพื่อใช้ในการสลายพันธะเดิมออกให้หมดและผลิตภัณฑ์ต้องมีการสร้างพันธะขึ้นมาใหม่จะคายพลังงานออกมา
ถ้าระบบดูดพลังงาน คายพลังงาน ปฏิกิริยาจะดูดพลังงาน = พลังงานที่ดูด - พลังงานที่คาย
ถ้าระบบคายพลังงาน ดูดพลังงาน ปฏิกิริยาจะคายพลังงาน = พลังงานที่คาย – พลังงานที่ดูด

รูปร่างโมเลกุลโคเวเลนต์
รูปร่างโมเลกุลโคเวเลนต์ขึ้นอยู่กับ ทิศทางของพันธะโคเวเลนต์ , ความยาวพันธะ , และมุมระหว่างพันธะโคเวเลนต์รอบอะตอมกลางทิศทางของพันธะขึ้นอยู่กับ- แรงผลักระหว่างพันธะรอบอะตอมกลาง เพื่อให้ห่างกันมากที่สุด-แรงผลักของอิเล็กตรอนคู่อิสระของอะตอมกลางที่มีต่อพันธะรอบอะตอมกลางแรงนี้มีค่ามากกว่าแรงที่พันธะผลักกันเองรูปร่างโมเลกุลโคเวเลนต์ที่ควรรู้จัก1.รูปร่างเส้นตรง(Limear) โมเลกุล BeCl2และสูตรโครงสร้างดังนี้
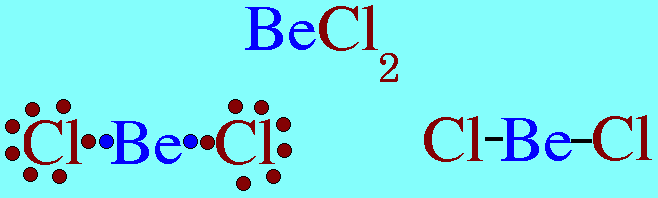
อะตอมกลาง Be ในโมเลกุล BeCl2มีอิเล็กตรอนทั้งหมด 2 ตัว และทั้ง 2 ตัวเป็นอิเล็กตรอนคู่ร่วมพันธะ ซึ่งจะผลักกันให้ห่างกันให้มากที่สุด ทำให้โมเลกุลเป็นรูปเส้นตรง มีมุมระหว่างพันธะ 180๐ดังรูป
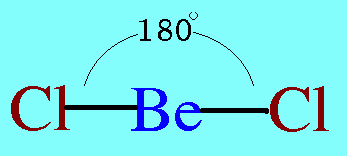 โมเลกุล CO2มีสูตรโครงสร้างดังนี้
โมเลกุล CO2มีสูตรโครงสร้างดังนี้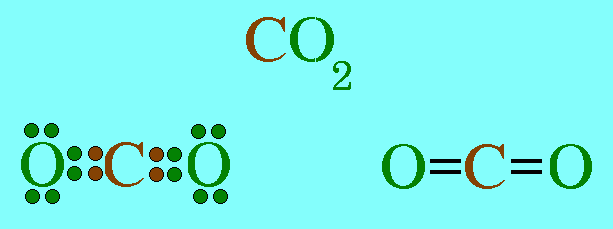
อะตอมกลาง C ในโมเลกุล CO2มีเวเลนต์อิเล็กตรอน 4 ตัว และทั้ง 4 ตัวเป็นอิเล็กตรอนคู่ร่วมพันธะ(เกิดพันธะคู่กับอะตอม O 2 พันธะ) ทำให้เกิดแรงผลักกันระหว่างพันธะให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปเส้นตรง มีมุมระหว่างพันธะ 180๐ดังรูป
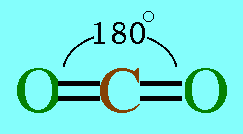
สรุปโมเลกุลของสารโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 2 พันธะ จะเป็นพันธะชนิดใดก็ได้ และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็นเส้นตรง2. รูปร่างสามเหลี่ยมแบนราบ(Trigonal planar)โมเลกุล BCl3มีสูตรโครงสร้าง ดังนี้
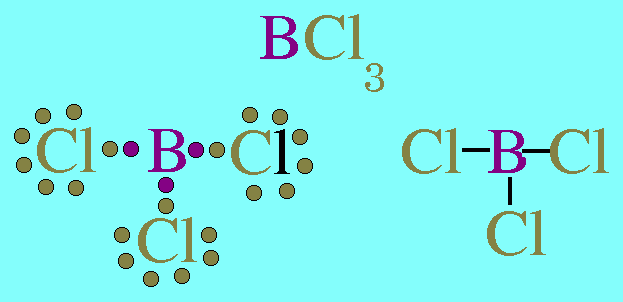
อะตอมกลาง B ในโมเลกุล BCl3มีเวเลนต์อิเล็กตรอน 3 ตัว และเป็นอิเล็กตรอนคู่ร่วมพันธะทั้งหมด (สร้างพันธะเดี่ยวกับอะตอม Cl 3 พันธะ) พันธะผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปสามเหลี่ยมแบนราบ มีมุมระหว่างพันธะเป็น 120๐ดังรูป
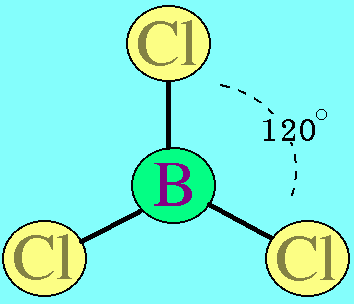
สรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 3 พันธะ (ไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็น สามเหลี่ยมแบนราบ3. รูปร่างทรงสี่หน้าโมเลกุลมีเธน CH4มีสูตรโครงสร้างดังนี้
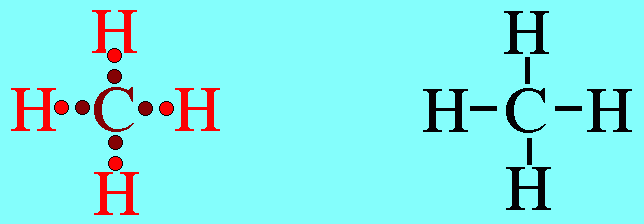
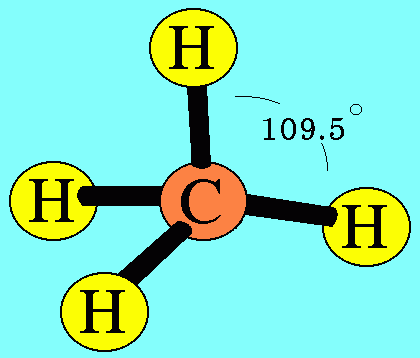
อะตอม C ในโมเลกุล CH4มีเวเลนต์อิเล็กตรอน 4 ตัว และเป็นอิเล็กตรอนคู่ร่วมพันธะทั้งหมด (สร้างพันธะเดี่ยวกับอะตอม H 4 พันธะ) เกิดการผลักกันระหว่างพันธะเพื่อให้ห่างกันมากที่สุด ทำให้โมเลกุลมีรูปร่างเป็นรูปทรงสี่หน้า มีมุมระหว่างพันธะเป็น 109.5๐ดังรูปสรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 4 พันธะ (โดยไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็น ทรงสี่หน้า4. รูปร่างพีระมิดฐานสามเหลี่ยม (Trigonal bipyramkial)โมเลกุล PCl5มีสูตรโครงสร้างดังนี้
สรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 4 พันธะ (โดยไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็น ทรงสี่หน้า4. รูปร่างพีระมิดฐานสามเหลี่ยม (Trigonal bipyramkial)โมเลกุล PCl5 มีสูตรโครงสร้างดังนี้
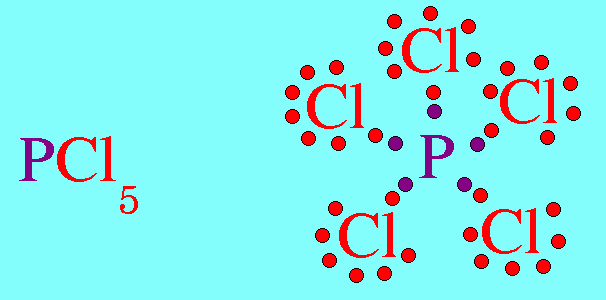
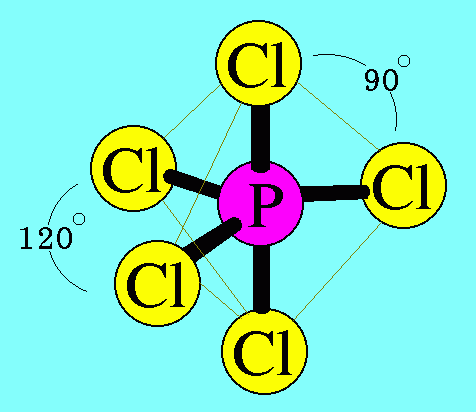
อะตอมของ P ในโมเลกุล PCl5มีเวเลนต์อิเล็กตรอน = 5 สร้างพันธะเดี่ยวกับอะตอมของ Cl ทั้ง 5 ต้ว ไม่มีอิเล็กตรอนคู่โดดเดี่ยว พันธะผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลมีรูปร่างพีระมิดคู่
ฐานสามเหลี่ยม มีมุมระหว่างพันธะเป็น 120๐และ 90๐ดังรูป
5. ทรงแปดหน้า(Octahedral)
โมเลกุล SF6 มีสูตรโครงสร้างดังนี้
อะตอมของ S มีเวเลนต์อิเล็กตรอน = 6 อิเล็กตรอนทั้ง 6 ตัวสร้างพันธะเดี่ยวกับอะตอมของ F ทั้ง 6 ตัว (ไม่มีอิเล็กตรอนคู่โดดเดี่ยว) อิเล็กตรอนคู่ร่วมพันธะ(พันธะ) เกิดการผลักกันให้ห่างกันมากที่สุด จึงทำให้มีรูปร่างโมเลกุลเป็นรูปทรงแปดหน้า มีมุมระหว่างพันธะ 90๐ดังรูป
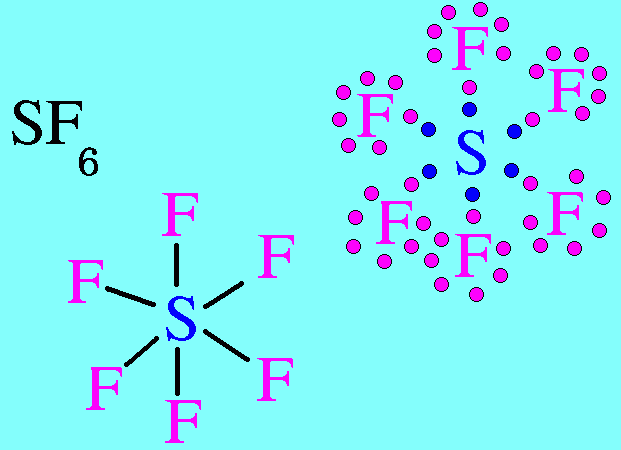
อิเล็กตรอนคู่โดดเดี่ยวกับรูปร่างโมเลกุล
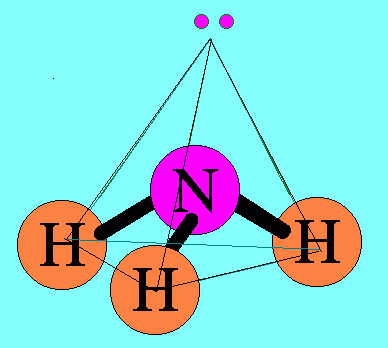
ตามปรกติอิเล็กตรอนแต่ละคู่จะออกแรงผลักกัน แรงผลักของอิเล็กตรอนแต่ละคู่จะไม่เท่ากัน ซึ่งสามารถเขียนแรงผลักระหว่างอิเล็กตรอนคู่ต่างๆ จากมากไปหาน้อยได้ดังนี้ อิเล็กตรอนคู่โดเดี่ยวกับอิเล็กตรอนคู่โดดเดี่ยว > อิเล็กตรอนคู่โดดเดี่ยวกับอิเล็กตรอนคู่ร่วมพันธะ > อิเล็กตรอนคู่ร่วมพันธะกับอิเล็กตรอนคู่ร่วมพันธะ6. รูปร่างพีระมิดฐานสามเหลี่ยมโมเลกุล NH3มีสูตรโครงสร้างดังนี้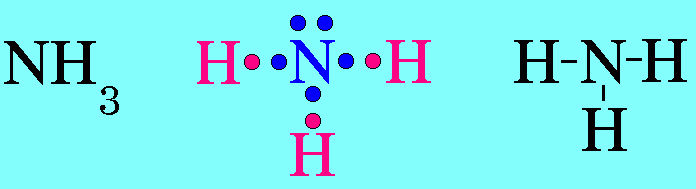
อะตอม N ในโมเลกุล NH3มีเวเลนต์อิเล็กตรอน = 5 สร้างพันธะเดี่ยวกับอะตอมของ H 3 พันธะเหลืออิเล็กตรอนไม่ได้ร่วมพันธะ 1 คู่(อิเล็กตรอนคู่โดดเดี่ยว) อิเล็กตรอนทั้ง 4 คู่รอบอะตอมกลาง ( N ) จะผลักกันให้ห่างกันมากที่สุด แต่เนื่องจากแรงผลักระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอิเล็กตรอนคู่ร่วมพันธะ มีค่ามากกว่าแรงผลักระหว่างอิเล็กตรอนคู่ร่วมพันธะผลักกันเอง จึงทำให้มุมระหว่างพันธะ H – N ลดลงเหลือ 107๐และรูปร่างโมเลกุลเป็น รูปพีระมิดฐายสามเหลี่ยม ดังรูป
 7. รูปร่างมุมงอ
7. รูปร่างมุมงอ
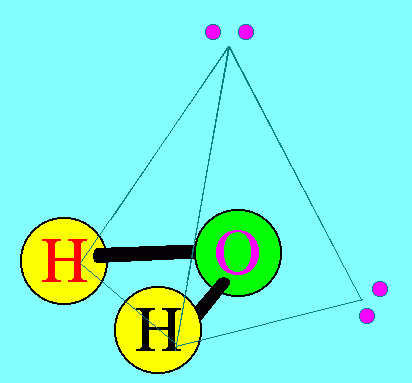
โมเลกุล H2O มีสูตรโครงสร้างดังนี้
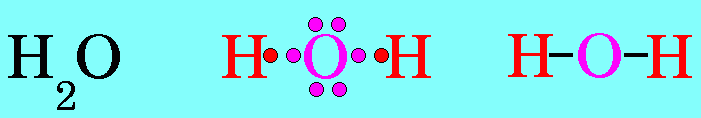
อะตอมกลาง O ในโมเลกุลของ H2O มีเวเลนต์อิเล็กตรอน = 6 สร้างพันธะเดี่ยวกับอะตอมของ H 2 พันธะ จึงมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ (4 ตัว) ซึ่งอิเล็กตรอนคู่โดดเดี่ยว 2 คู่นี้ จะมีแรงผลักอิเล็กตรอนคู่ร่วมพันธะ มากกว่าแรงผลักกันของอิเล็กตรอนคู่ร่วมพันธะ ทำให้มุมระหว่างพันธะ H – O – H มีค่าลดลงเหลือ 105๐รูปร่างโมเลกุลจึงไม่เป็นเส้นตรง แต่เป็นรูปมุมงอหรือตัววี ดังรูป
สภาพขั้วโมเลกุลโคเวเลนต์
สภาพมีขั้วของโมเลกุลในพันธะโคเวเลนต์ อิเล็กตรอนคู่ร่วมพันธะจะเคลื่อนที่อยู่ระหว่างอะตอมทั้งสองที่สร้างพันธะกัน ถ้าพบว่าอิเล็กตรอนคู่ร่วมพันธะเคลื่อนที่อยู่ตรงกลางระหว่างอะตอมพอดี แสดงว่าอะตอมคู่นั้นมีความสามารถในการดึงดูดอิเล็กตรอนคู่ร่วมพันธะเท่ากัน แต่ถ้าพบว่าอิเล็กตรอนคู่ร่วมพันธะเคลื่อนที่อยู่ใกล้อะตอมใดอะตอมหนึ่งมากกว่าอีกอะตอมหนึ่ง แสดงว่าอะตอมคู่นั้น มีความสามารถในการดึงดูดอิเล็กตรอนคู่ร่วมพันธะไม่เท่ากัน ดังภาพ


อิเล็กตรอนถ่ายเทจากอะตอมหนึ่งไปสู่อีกอะตอมหนึ่ง
ค่าที่บอกให้ทราบถึงความสามารถในการดึงดูดอิเล็กตรอนของธาตุที่สร้างพันธะกันเป็นสารประกอบเรียกว่าอิเล็กโทรเนกาติวิตี (Electronegativity) ค่าอิเล็กโทรเนกาติวิตี จะมีค่ามากหรือน้อยขึ้นอยู่กับจำนวนประจุในนิวเคลียส และระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสธาตุที่มีจำนวนประจุในนิวเคลียสมาก แต่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันน้อย จะมีค่าค่าอิเล็กโทรเนกาติวิตีสูงกว่าธาตุที่มีมีจำนวนประจุในนิวเคลียสน้อย แต่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันมาก
ค่าอิเล็กโทรเนกาติวิตี (EN)

ค่าอิเล็กโทรเนกาติวิตีนำไปใช้อธิบายสมบัติบางประการของสารได้ เช่น ขั้วของพันธะโคเวเลนต์
- ถ้าพันธะโคเวเลนต์เกิดจากอะตอมที่มีค่าค่าอิเล็กโทรเนกาติวิตีเท่ากัน เช่นพันธะในโมเลกุลของ H2, O2, N2, F2, Br2, I2, P4อิเล็กตรอนคู่ร่วมพันธะจะอยู่ตรงกลางระหว่างอะตอมทั้งสองเป็นส่วนใหญ่ หรืออาจกล่าวได้ว่าอิเล็กตรอนคู่ร่วมพันธะจะถูกนิวเคลียสของอะตอมทั้งสองดึงดูดด้วบแรงเท่าๆกัน เราเรียกพันธะโคเวเลนต์ที่เกิดขึ้นในลักษณะนี้ว่าพันธะโคเวเลนต์ไม่มีขั้วสรุป พันธะที่เกิดจากอะตอมของธาตุชนิดเดียวกันเป็นพันธะไม่มีขัว
- ถ้าพันธะโคเวเลนต์เกิดจากอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่างกัน อะตอมที่มีค่าอิเล็กโทรเนกาติวิตีมากกว่า จะดึงอิเล็กตรอนคู่ร่วมพันธะเข้ามาใกล้ตัวมันเอง อะตอมนี้จะแสดงอำนาจไฟฟ้าเป็นลบ และอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีน้อยกว่าจะถูกดึงอิเล็กตรอนคู่ร่วมพันธะไป อะตอมนี้จะแสดงอำนาจไฟฟ้าบวก เราเรียกพันธะโคเวเลนต์ชนิดนี้ว่าพันธะโคเวเลนต์มีขั้ว
การแสดงขั้วของพันธะโคเวเลนต์ ใช้สัญลักษณ์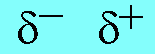
และความแรงของขั้วของพันธะขึ้นกับผลต่างของค่าอิเล็กโทรเนกาติวิตีของอะตอมคู่สร้างพันธะ โดยถ้าค่าอิเล็กโทรเนกาติวิตีแตกต่างกันมากกว่า สภาพขั้วจะแรงกว่า เช่น H – F มีสภาพขั้วแรงกว่า H – Cl
สรุปพันธะที่เกิดจากอะตอมต่างชนิดกันเป็นพันธะมีขั้วขั้วของโมเลกุลวิธีพิจารณาว่าโมเลกุลใดมีขั้วหรือไม่มีขั้วมีหลักดังนี้
1.โมเลกุลใดที่มีแต่พันธะที่ไม่มีขั้วทั้งสิ้น จัดเป็นโมเลกุลที่ไม่มีขั้ว เช่น H2, O2, N2, F2, Br2, I2, P42.โมเลกุลใดที่มีพันธะมีขั้ว โมเลกุลนั้นอาจมีขั้วหรือไม่มีขั้วก็ได้ ขึ้นกับการเขียนเวกเตอร์ แล้วดูการหักล้างกันของทิศทางของขั้วของพันธะรอบอะตอมกลาง ถ้าหักล้างกันหมดโมเลกุลนั้นจะไม่มีขั้ว แต่ถ้าหักล้างกันไม่หมดโมเลกุลนั้นจะมีขั้วโดยทิศทางของขั้วลบของโมเลกุลชี้ไปทางทิศทางของผลลัพธ์ เช่นและความแรงของขั้วของพันธะขึ้นกับผลต่างของค่าอิเล็กโทรเนกาติวิตีของอะตอมคู่สร้างพันธะ โดยถ้าค่าอิเล็กโทรเนกาติวิตีแตกต่างกันมากกว่า สภาพขั้วจะแรงกว่า เช่น H – F มีสภาพขั้วแรงกว่า H – Clสรุปพันธะที่เกิดจากอะตอมต่างชนิดกันเป็นพันธะมีขั้วขั้วของโมเลกุลวิธีพิจารณาว่าโมเลกุลใดมีขั้วหรือไม่มีขั้วมีหลักดังนี้1.โมเลกุลใดที่มีแต่พันธะที่ไม่มีขั้วทั้งสิ้น จัดเป็นโมเลกุลที่ไม่มีขั้ว เช่น H2, O2, N2, F2, Br2, I2, P4
2.โมเลกุลใดที่มีพันธะมีขั้ว โมเลกุลนั้นอาจมีขั้วหรือไม่มีขั้วก็ได้ ขึ้นกับการเขียนเวกเตอร์ แล้วดูการหักล้างกันของทิศทางของขั้วของพันธะรอบอะตอมกลาง ถ้าหักล้างกันหมดโมเลกุลนั้นจะไม่มีขั้ว แต่ถ้าหักล้างกันไม่หมดโมเลกุลนั้นจะมีขั้วโดยทิศทางของขั้วลบของโมเลกุลชี้ไปทางทิศทางของผลลัพธ์ เช่นและความแรงของขั้วของพันธะขึ้นกับผลต่างของค่าอิเล็กโทรเนกาติวิตีของอะตอมคู่สร้างพันธะ โดยถ้าค่าอิเล็กโทรเนกาติวิตีแตกต่างกันมากกว่า สภาพขั้วจะแรงกว่า เช่น H – F มีสภาพขั้วแรงกว่า H – Clสรุปพันธะที่เกิดจากอะตอมต่างชนิดกันเป็นพันธะมีขั้ว
แรงยึดเหนี่ยวโมเลกุล
แรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์การเปลี่ยนสถานะของสารต้องมีการให้ความร้อนแก่สาร เพื่อให้อนุภาคของสารมีพลังงานจลน์สูงพอที่จะหลุดออกจากกัน แสดงว่าสารแต่ละสถานะมีแรงยึดเหนี่ยวระหว่างโมเลกุล ซึ่งเรียงลำดับจากมากไปน้อยดังนี้ ของแข็ง > ของเหลว > ก๊าซการเปลี่ยนสถานะของสารโคเวเลนต์ มีการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลเท่านั้น ไม่มีการทำลายพันธะเคมี ดังนั้นสารที่มีจุดเดือดจุดหลอมเหลวสูง แสดงว่าแรงยึดเหนี่ยวระหว่างโมเลกุลสูงประเภทของแรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์ มีดังนี้
- แรงลอนดอน ( london foece ) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล ยึดเหนี่ยวกันด้วยแรงอ่อนๆ ซึ่งเกิดขึ้นในสารทั่วไป และจะมีค่าเพิ่มขึ้นตามมวลโมเลกุลของสาร
- แรงดึงดูดระหว่างขั้ว (dipole – dipole force ) เป็นแรงดึงดูดทางไฟฟ้าอันเนื่องมาจากแรงกระทำระหว่างขั้วบวกกับขั้วลบของโมเลกุลที่มีขั้ว
สารโคเวเลนต์ที่มีขั้ว มีแรงยึดเหนี่ยวระหว่างโมเลกุล 2 ชนิดรวมอยู่ด้วยกันคือ แรงลอนดอนกับแรงดึงดูดระหว่างขั้ว และเรียกแรง 2 แรงรวมกันว่าแรงแวนเดอร์วาลส์3. พันธะไฮโดรเจน(hydrogen bond , H – bond ) คือ แรงดึงดูดระหว่างโมเลกุลที่เกิดจากไฮโดรเจนอะตอมสร้างพันธะโคเวเลนต์ กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงๆและมีขนาดเล็ก ได้แก่ F , O และ N แล้วเกิดพันธะโคเวเลนต์มีขั้วชนิดมีสภาพขั้วแรงมาก ทั้งนี้เนื่องจากพันธะที่เกิดขึ้นนี้อิเล็กตรอนคู่รวมพันธะจะถูกดึงเข้ามาใกล้อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง มากกว่าทางด้านอะตอมของไฮโดรเจนมาก และอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง ยังมีอิเล็กตรอนคู่โดดเดี่ยว จึงเกิดดึงดูดกันระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอะตอมของไฮโดรเจนชึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็นพันธะไฮโดรเจน
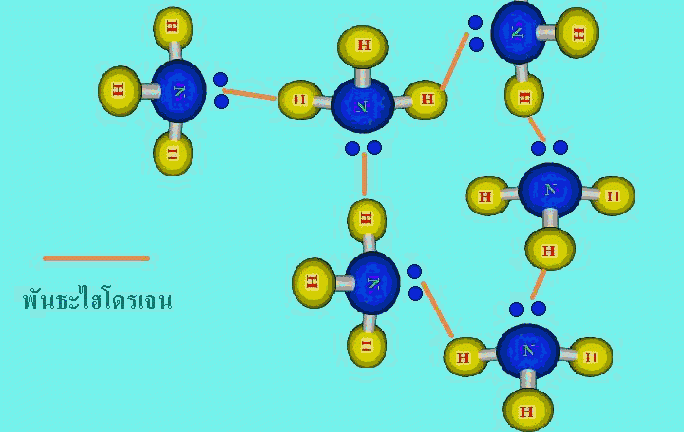
แรงยึดเหนี่ยวระหว่างโมเลกุลทั้ง 3 ชนิดนี้ พันธะไฮโดรเจนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงที่สุด ขณะที่แรงลอนดอนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงน้อยที่สุด และทั้ง 3 แรงนี้แข็งแรงน้อยกว่าพันธะโคเวเลนต์ พันธะไออนิก และพันธะโลหะมาก
สมบัติของสารโคเวเลนต์
1. มีจุดเดือดจุดและหลอมเหลวต่ำ เพราะจะทำให้เดือดหรือหลอมเหลวต้องใช้พฃังงานไปในการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุล ( ไม่ได้ทำลายพันธะโคเวเลนต์ ยกเว้นโครงผลึกร่างตาข่าย ) อาจจะแบ่งสารโคเวนต์ตามจุดเดือด จุดหลอมเหลว จะได้ 4 พวกดังนี้
1.1สารโคเวเลนต์ไม่มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวต่ำกว่าพวกอื่นๆ เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงลอนดอนอย่างเดียวเท่านั้น1.2 สารโคเวเลนต์มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าพวกไม่มีขั้ว เพราะยึดเหนี่ยวโมเลกุลด้วยแรง 2 แรง คือแรงลอนดอลและแรงดึงดูดระหว่างขั้ว1.3 สารโคเวเลนต์ที่สามารถสร้างพันธะไฮโดรเจนได้ เช่น HF , NH3, H2Oพวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าสารโคเวเลนต์ที่มีขั้ว เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์และพันธะไฮโดรเจน1.4 พวกที่มีโครงสร้างเป็นโครงผลึกร่างตาข่าย เช่น เพชร แกรไฟต์ คาร์บอรันดัม ซิลิกอนไดออกไซด์ พวกนี้มีจุดเดือดจุดหลอมเหลวสูงมาก ซึ่งโดยทั่วไปสารโคเวเลนต์มีจุดเดือดจุดหลอมเหลวต่ำ ที่เป็นเช่นนี้เพราะการจัดเรียงอะตอมภายในผลึก
2. สารโคเวเลนต์จะไม่นำไฟฟ้าไม่ว่าจะอยู่ในสถานะใด ( ยกเว้น แกรไฟต์ ) เนื่องจากไม่มีอิเล็กตรอนอิสระ และเมื่อหลอมเหลวไม่แตกตัวเป็นอิออน3. โมเลกุลที่มีขั้วสามารถละลายในตัวทำละลายที่โมเลกุลมีขั้วได้ และโมเลกุลที่ไม่มีขั้วสามารถละลายในตัวทำละลายที่ไม่มีขั้วได้(มีขั้วกับมีขั้ว , ไม่มีขั้วกับไม่มีขั้ว= ละลายกันได้ แต่มีขั้วกับไม่มีขั้วไม่ละลายกัน )
พันธะไฮโดรเจน
พันธะไฮโดรเจนคือ พันธะที่เกิดขึ้นอันเนื่องมาจากแรงดึงดูดระหว่างโมเลกุลสองโมเลกุล ซึ่งแต่ละโมเลกุลนั้นประกอบด้วยอะตอมของไฮโดรเจนสร้างพันธะโคเวเลนต์กับอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตี (en) สูงมากๆ เช่น F, O และ N ซึ่งมีค่าอิเล็กโทรเนกาติวิตีประมาณ 3.98, 3.44 และ 3.04 ตามลำดับ เช่น การเกิดพันธะไฮโดรเจนระหว่างอะตอม ไฮโดรเจน และ ออกซิเจน แสดงได้ดังรูป
เปรียบเทียบโครงสร้างของน้ำและนำ้แข็ง
ในกรณีของน้ำโมเลกุลแต่ละโมเลกุลของน้ำอาจเกิดพันธะไฮโดรเจนกับโมเลกุลของน้ำข้างเคียงอีกสี่อะตอม (ดังรูป) โครงสร้างของน้ำที่เป็นของเหลว เกิดจากโมเลกุลของน้ำหลายๆโมเลกุลยึดกันด้วยพันธะไฮโดรเจน แต่ว่ายังไม่ค่อยเป็นระเบียบนักเนื่องจากโครงสร้างของน้ำมีส่วนหนึ่งดึงดูดกันอยู่ด้วยแรงขั้วคู่-ขั้วคู่ และ การสร้างและสลายพันธะไฮโดรเจนตลอดเวลา โครงสร้างของน้ำ (ของเหลว) แสดงได้ดังรูป
http://www.nyu.edu/pages/mathmol/textbook/info_water.html
ในกรณีของน้ำแข็งโมเลกุลของน้ำแต่ละโมเลกุลสร้างพันธะไฮโดรเจนกับโมเลกุลอื่นๆอีก 4 โมเลกุลเช่นเดียวกัน แต่มีความเป็นระเบียบมากกว่า โดยระยะห่างระหว่างออกซิเจนของโมเลกุลของตัวมันเองกับโมเลกุลใกล้เคียงมีค่าประมาณ 2.76 อังสตรอม (Ao) ผลึกของน้ำแข็งมีได้หลายรูป แต่รูปที่พบในธรรมชาติ คือ hexagonal
www.ill.fr/dif/ 3D-gallery.html
เพื่อความเข้าใจมากขึ้นขออธิบายพันธะไฮโดรเจนผ่านกระบวนการการเกิดเป็นน้ำแข็งของน้ำ ซึ่งจะช่วยให้แยกแยะระหว่างพันธะโคเวเลนต์กับพันธะไฮโดรเจนได้เป็นอย่างดี
น้ำ 1 โมเลกุลประกอบด้วย
ไฮโดรเจน 2 อะตอม
ออกซิเจน 1 อะตอมออกซิเจนซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 6 ดังนั้นเมื่อใช้อิเล็กตรอนไป 2 ตัวเพื่อเกิดพันธะโคเวเลนต์กับ H สองอะตอม (อะตอมละ 1 อิเล็กตรอน) จึงเหลือ 4 อิเล็กตรอนหรือมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ ดังรูป
การเกิดพันธะไฮโดรเจนในกรณีนี้เกิดจากแรงดึงดูดระหว่างอะตอมของ H ซึ่งมีประจุบวก กับอิเล็กตรอนคู่โดดเดี่ยวซึ่งมีประจุลบ ดังรูป
ดังนั้นน้ำแข็งจึงเกิดจากโมเลกุลของน้ำหลายๆโมเลกุลเชื่อมกัน หรืออาจกล่าวได้ว่าอะตอมของ O เชื่อมกันโดยอาศัยพันธะโคเวเลนต์และพันธะไฮโดรเจนร่วมกัน โดย 1 อะตอมของออกซิเจนจะเชื่อมกับอีก 4 อะตอมของออกซิเจน ดังรูป
เกิดเป็นผลึกของน้ำแข็งมีลักษณะโครงสร้างคล้ายเพชร ดังรูป
| |
|
| เพื่อที่จะสามารถมองและเข้าใจเกี่ยวกับพันธะไฮโดรเจนได้กว้างขึ้น ให้นักเรียนลองพิจารณาพันธะไฮโดรเจนใน DNA (deoxyribonucleic acid) เป็นที่รู้กันว่าโครงสร้างของ DNA ประกอบด้วยสามส่วนที่สำคัญ คือ หมู่ฟอสเฟต น้ำตาล และ เบส ซึ่งเบส ที่พบใน DNA มี 4 ชนิด คือ Adenine(A), Thymine(T), Guanine(G), Cytosine(C)ต่อกันเป็นสายยาวแบบเกลียวคู่ (double helix) โดยเบสที่เข้าคู่จะมีความจำเพาะ นั่นคือโดยทั่วไปแล้ว เบส A จะเข้าคู่กับ T และ C จะเข้าคู่กับ Gทำไมถึงเป็นเช่นนั้นหละ ? ถ้าอยากรู้ลองพิจารณาจากรูปครับ |
จากรูปจะเห็นว่าการที่ เบส A เข้าคู่กับ เบส T และเบส C เข้าคู่กับเบส G ทำให้รูปร่างของคู่เบสในสามมิติ คล้ายคลึงกันมาก ทำให้ DNA มีรูปร่างเป็นเกลียวคู่สม่ำเสมอมากทีเดียว จากรูปเป็นการจับคู่เบสตามแนวคิดของ Watson-Crick ซึ่งได้รับการพิสูจน์แล้วว่าเป็นจริงเมื่อพิจารณาการเกิดพันธะไฮโดรเจนจะเห็นว่า Adenine สามารถสร้างพันธะไฮโดรเจนกับ Thymine ได้ สองพันธะ และ Cytosine สามารถสร้างพันธะไฮโดรเจนกับ Guanine ได้ สาม พันธะพอดี ซึ่งพันธะไฮโดรเจนที่เกิดขึ้นถึงแม้จะมีความแข็งแรงน้อยกว่า พันธะโคเวเลนต์ แต่อย่างไรก็ตามในโมเลกุลของ DNA มีจำนวนพันธะไฮโดรเจนเกิดขึ้นมากมาย ดังนั้นจึงเสริมแรงกันและ ทำให้โมเลกุลของ DNA ที่เป็น double helix มีความเสถียร นอกจากนี้ถ้าเปรียบเทียบความแข็งแรงของแรงยึดเหนี่ยวระหว่าง คู่เบส A-T และ C-G จะเห็นว่า C-G มีความแข็งแรงมากกว่าเพราะมีพันธะไฮโดรเจนมากกว่า (เบส C สร้างพันธะไฮโดรเจนกับ G สามพันธะ ในขณะที่ เบส A สร้างพันธะไฮโดรเจนกับ T สองพันธะ
แรงแวนเดอร์วาล์ส
แรงแวนเดอร์วาลส์คือ แรงดึงดูดแบบอ่อนๆที่ช่วยยึดโมเลกุลเข้าด้วยกัน เช่น ก๊าซไฮโดรเจน คาร์บอนไดออกไซด์ ไนโตรเจน และในก๊าซเฉื่อย เช่น ฮีเลียม (He), นีออน (Ne), อาร์กอน (Ar) และ คริบตอน (Kr) เป็นต้น
แรงแวนเดอร์วาลส์มี 3 ชนิด คือ ลักษณะการจัดตัวของไดโพลคู่ซึ่งให้ผลออกมา เป็นแรงผลักแรงไดโพลมีบทบาทสำคัญในการจัดเรียงตัวที่เป็นระเบียบของโมเลกุลในผลึก สำหรับโมเลกุลในสถานะแก๊สและของเหลว โมเลกุลมีการจัดเรียงตัวอย่างไม่เป็นระเบียบ เพราะมีการเคลื่อนไหวมากจึงเป็นผลให้แรงไดโพลมีทั้งแบบผลักและดึงดูด ซึ่งทำให้แรงลัพธ์ออกมา เป็นแรงดึงดูดอย่างอ่อนๆ 2. แรง dipole-induced dipole คือ แรงที่เกิดจากโมเลกุลที่มีขั้วเหนี่ยวนำให้โมเลกุล หรืออะตอมตัวอื่นมีขั้วด้วย จากนั้นอะตอมหรือโมเลกุลดังกล่าวก็มีแรงกระทำต่อกันเกิดขึ้น ซึ่งแรงนี้จะมากหรือน้อยขึ้นอยู่กับความสามารถในการเกิดมีขั้ว (polarizability) ของโมเลกุลที่ถูกเหนี่ยวนำ โดยทั่วไปอะตอมหรือโมเลกุลที่มีขนาดใหญ่ จะมีความสามารถในการเกิดมีขั้วสูงกว่า อะตอมหรือโมเลกุลที่มีขนาดเล็ก |
3. แรง London(dispersion)คือ แรงดึงดูดระหว่างโมเลกุลที่ไม่มีขั้วด้วยกัน เช่น O2, Ne2เป็นต้น เนื่องจากอิเล็กตรอนเคลื่อนที่แบบไร้ทิศทางทำให้บางครั้ง อิเล็กตรอนมากระจุกกันอยู่บริเวณเดียวกันทำให้เกิดประจุลบบางส่วน(ประจุลบชั่วคราวที่มีค่าประจุน้อยมาก)เกิดขึ้น และทำให้บริเวณที่ไม่มีอิเล็กตรอนอยู่เกิดประจุบวกบางส่วน(ประจุบวกชั่วคราวที่มีค่าประจุน้อยมาก)ซึ่งแสดงได้ดังรูป
หลังจากอะตอมจะกลายเป็นอะตอมที่มีขั้วชั่วคราว อะตอมที่มีขั้วก็จะเหนี่ยวนำให้อะตอมใกล้เคียงกลายเป็นอะตอมที่มีขั้วตามไปด้วย ซึ่งแสดงได้ดังรูป
จากรูปแสดงการเกิดแรงลอนดอนของ Ne โดยจุดสีแดงคือ electron จะเห็นว่าบางครั้งอิเล็กตรอนอยู่ ณ.บริเวณใดบริเวณหนึ่งของอะตอมมากกว่าบริเวณหนึ่งกลายเป็นอะตอมที่มีขั้วบางส่วน จากนั้นก็จะเหนี่ยวนำให้อะตอม Ne ใกล้เคียงกลายเป็นอะตอมที่มีขั้วบางส่วนตามไปด้วย จึงเกิดแรงดึงดูดซึ่งกันและกันแต่ว่าเป็นแรงดึงดูดแบบอ่อน
โดยทั่วไปแล้วที่ความดันสูงและอุณหภูมิต่ำแรงแวนเดอร์วาลส์สามารถทำให้โมเลกุลของก๊าซที่ไม่มีขั้วกลายเป็นโมเลกุล
ในสถานะของเหลวได้
แรงชนิดนี้จะมีความแข็งแรงมากขึ้นถ้าโมเลกุลมีขนาดใหญ่ขึ้นทำไม?นั่นเป็นเพราะว่าโมเลกุลขนาดใหญ่กว่าจะมีอิเล็กตรอนมากกว่า ซึ่งบางครั้งอิเล็กตรอนเหล่านั้นมารวมกันอยู่ ณ บริเวณหนึ่งๆในอะตอมมากกว่าบริเวณหนึ่งทำให้เกิดประจุบางส่วนขึ้น แต่เนื่องจากมีจำนวนอิเล็กตรอนมากดังนั้นประจุที่เกิดจึงมีค่ามากกว่าจึงเหนี่ยวนำให้เกิดประจุที่แข็งแรงกว่า
ข้อควรรู้ไม่ว่าจะเป็นพันธะไอออนิกหรือพันธะเคมีอื่นๆ เช่นการเกิด NaCl หรือ พันธะโคเวเลนต์ เช่น การเกิดเป็นโมเลกุลของฟลูออรีน สามารถเกิดแรงแวนเดอร์วาลส์ก่อนที่จะเกิดพันธะดังกล่าวได้แต่แรงดังกล่าวมีค่าน้อยมาก เมื่อเทียบกับแรงที่เกิดขึ้นอันเนื่องมาจากพันธะเคมีอื่นๆที่เกิดขึ้น




ไม่มีความคิดเห็น:
แสดงความคิดเห็น